(10分)某无色溶液中含有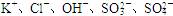 ,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂②~④溶质的化学式分别是:②_________,③_________,④_________,
(2)图中现象a、c表明检验出的离子分别是:a________、c_________
(10分)某无色溶液中含有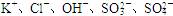 ,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂②~④溶质的化学式分别是:②_________,③_________,④_________,
(2)图中现象a、c表明检验出的离子分别是:a________、c_________