Ⅰ、为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下列三种实验装置,请回答下列问题: 
(1)请写出CO2与过量的NaOH发生反应的离子方程式: 。
(2)选择任意一种实验装置进行实验,简述预计出现的实验现象。你选择的实验装置是 (填“甲”或“乙”或“丙”),实验现象是 。
(3)上述实验中,如果二氧化碳过量,还可能生成 (写化学式),写出生成此物质的离子反应方程式
Ⅱ、为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通。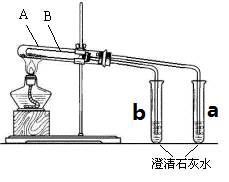
(1)小试管B中应装的药品是 (写化学式)。
(2)小试管a中出现的现象预计是 。
Ⅲ、工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀经______________(填操作)、洗涤、烘干、称量,洗涤沉淀的操作是 。
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液为饱和碳酸氢钠溶液,因为二氧化碳难溶于饱和碳酸氢钠溶液,但选用该溶液后实验结果仍然不够准确,会使Na2CO3的质量分数偏大,其原因可能是 。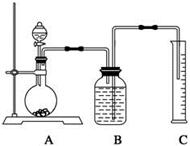




 粤公网安备 44130202000953号
粤公网安备 44130202000953号