酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液 紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 
(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 。(填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次
实验草酸溶液的用量均为8mL)。
| 实验编号 |
温 度(℃) |
催化剂用量(g) |
酸性高锰酸钾溶液 |
实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 |
| 体积(mL) |
浓度 (mol•L-1) |
|||
| 1 |
25 |
0.5 |
4 |
0.1000 |
| 2 |
50 |
0.5 |
4 |
0.1000 |
| 3 |
25 |
0.5 |
4 |
0.0100 |
| 4 |
25 |
0 |
4 |
0.1000 |
(4)写出表中a 对应的实验目的 ;
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 |
溶液褪色所需时间(min) |
||
| 第1 次 |
第2 次 |
第3 次 |
|
| 1 |
14.0 |
13.0 |
11.0 |
| 3 |
6.5 |
6.7 |
6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)为 。
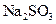 样品(含少量
样品(含少量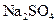 杂质)的纯度,实验室按以下步骤进行:①称取
杂质)的纯度,实验室按以下步骤进行:①称取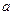
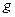 样品,置于烧杯中;
样品,置于烧杯中;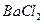 溶液,充分搅拌,使沉淀完全;
溶液,充分搅拌,使沉淀完全;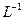 的酸性
的酸性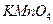 溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。
溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。
 ______________________________________;
______________________________________;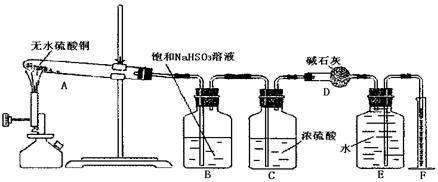
 被
被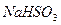 溶液吸收时产生了
溶液吸收时产生了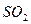 气体
气体 出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为mol,三氧化硫为mol。
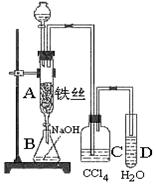
出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为mol,三氧化硫为mol。 口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
 ____________________。
____________________。 验,反应结束后,测其实验前后的质量,由此得到乙烯产量。
验,反应结束后,测其实验前后的质量,由此得到乙烯产量。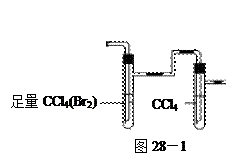 方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。
方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。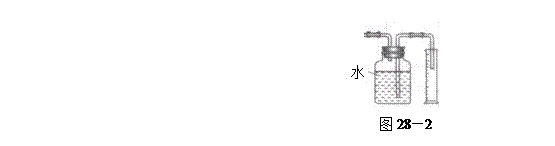
 粤公网安备 44130202000953号
粤公网安备 44130202000953号