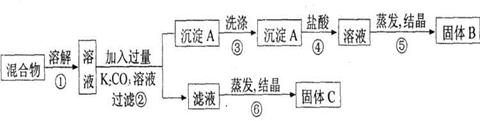
(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
 Na2S(s)+4H2O(g)。请回答下列问题:
Na2S(s)+4H2O(g)。请回答下列问题: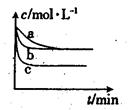

 粤公网安备 44130202000953号
粤公网安备 44130202000953号