下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①、②均为工业上的重要反应。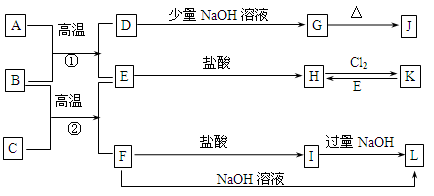
请回答下列问题:
(1)G是 ,K是 (填化学式)。
(2)C的原子结构示意图为 。
(3)写出B与C高温反应生成E和F的化学方程式: 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①、②均为工业上的重要反应。
请回答下列问题:
(1)G是 ,K是 (填化学式)。
(2)C的原子结构示意图为 。
(3)写出B与C高温反应生成E和F的化学方程式: 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。