二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)某实验小组同学用下列装置制取二氧化硫并探究铜与浓硫酸的反应后产物,进行了如下系列实验。
实验步骤: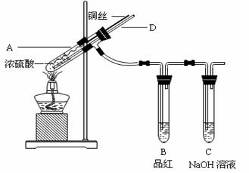
i:先连接好装置,检验气密性,加入试剂;
ii:加热A试管直到B中品红褪色,熄灭酒精灯;
iii:将Cu丝上提离开液面。
①装置A中发生反应的化学方程式为 。
②熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是 。
③拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
④实验过程中在试管A中没有观察到溶液呈蓝色,要证明反应后有Cu2+生成,接下来应该进行的操作是___________________________.
(2)某实验小组同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验:
①甲同学将SO2通入到Ba(OH)2溶液中得到白色沉淀,该反应的离子方程式为________________________________。
②乙同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
试剂A的化学式为________。实验表明,乙同学加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________________(填化学式),则产生该白色沉淀的原因是_____________________________________________________________。
 (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号