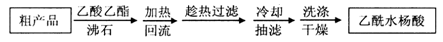铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
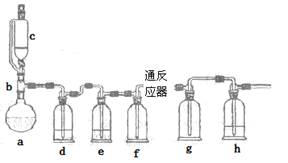
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
①完成下列表格
②实验2比实验1能够较快看到以上现象的原因是 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。


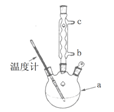
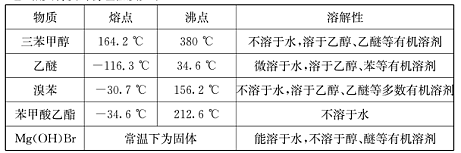
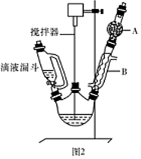
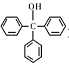 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。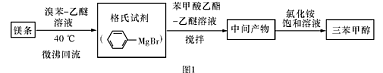
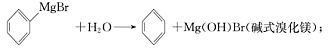

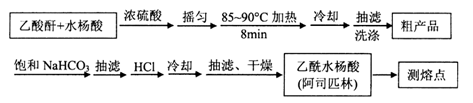
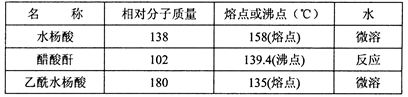
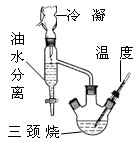
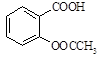 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: