从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下: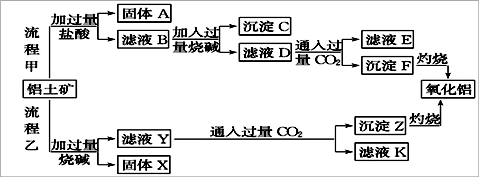
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为: ;
(2)流程乙加入烧碱后生成SiO32-的离子方程式为______。
(3)验证滤液B含Fe3+,可取少量滤液并加入______(填试剂名称)。
(4)滤液E中溶质的主要成分是____(填化学式),写出该溶液的一种用途 。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为: ;
(2)流程乙加入烧碱后生成SiO32-的离子方程式为______。
(3)验证滤液B含Fe3+,可取少量滤液并加入______(填试剂名称)。
(4)滤液E中溶质的主要成分是____(填化学式),写出该溶液的一种用途 。