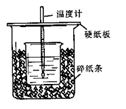
利用右图装置测定中和热的实验步骤如下:

①量取50mL 0.25mol•L-1硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol•L-1NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后,测量混合液温度。请回答:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________;
(2)NaOH溶液稍过量的原因_____________;
(3)加入NaOH溶液的正确操作是______(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_______;
(5)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18J/(g•℃),请根据实验数据写出该反应的热化学方程式 _____________;
温度
实验次数
|
起始温度t1/℃
|
终止温度
t2/℃
|
温度差平均值(t2-t1)/℃
|
H2SO4
|
NaOH
|
平均值
|
1
|
25.0
|
25.2
|
25.1
|
28.5
|
|
2
|
24.9
|
25.1
|
25.0
|
28.3
|
3
|
25.5
|
26.5
|
26
|
31.8
|
4
|
25.6
|
25.4
|
25.5
|
29.0
|
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) _______
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)______(填“能”或“不能”)用Ba(OH)2代替氢氧化钠溶液和稀硫酸反应;若将含0.5molH2SO4的 浓硫酸与含1molNaOH的溶液混合,放出的热量________(填“小于”、“等于”或“大于”)57.3kJ。原因是_______________________。





 粤公网安备 44130202000953号
粤公网安备 44130202000953号