某温度下在密闭容器中发生如下反应3 M(g)+ N(g) 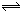 2G(g)
2G(g)
若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入3 molM和1molN的混合气体,达平衡时M的转化率为
| A.20% | B.40% | C.60% | D.80% |
某温度下在密闭容器中发生如下反应3 M(g)+ N(g) 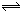 2G(g)
2G(g)
若开始时只充入2molG(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入3 molM和1molN的混合气体,达平衡时M的转化率为
| A.20% | B.40% | C.60% | D.80% |