(14分)为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。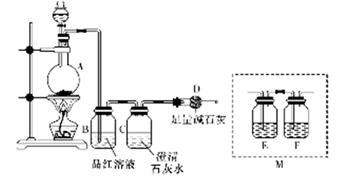
往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯。
(1)装置B的作用是______________________________________。
(2)甲同学观察到装置C中有白色沉淀生成。他得出了使澄清石灰水变浑浊的气体是二氧化碳的结论。装置A中能产生二氧化碳的化学方程式为_______________。
(3)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B~C之间添加装置M,装置E、F中盛放的试剂分别是_____、__________。重新实验后观察到装置F中的现象是__________。
(4)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。测定铁元素质量分数的实验步骤如下;
I.往烧瓶A中加入过量的还原剂铜粉使溶液中的Fe3+完全转化为Fe2+过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
①步骤II中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是___________________。
②滴定过程中_______________(填“需要”或“不需要")加入指示剂。
③铁碳合金中铁元素的质最分数为_____________________________。
 、Mg2+、
、Mg2+、 、Ba2+、
、Ba2+、 。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号