高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO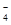 +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO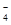 +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②配平后2种反应物前面的系数: MnO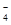 + CuS+…..
+ CuS+…..
II:在稀硫酸中,MnO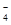 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO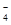 +8H++5e-===Mn2++4H2O
+8H++5e-===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是 mol。
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(5)用软锰矿制备K2MnO4的化学方程式是: 。
(6)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是 。(用“>”“<”或“=”表示)。
 2SO3(g) +190kJ
2SO3(g) +190kJ NH3·H2O
NH3·H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号