铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。已知氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
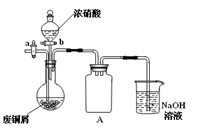
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。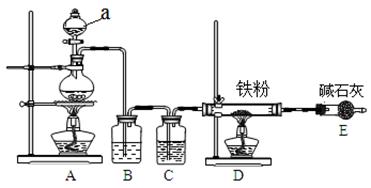
①装置A中仪器a的名称是___________。
②装置B的作用是______________,C中的试剂______________。
③实验开始时先点燃____处酒精灯;装置E的作用为________________________。
(2)工业上制备无水氯化铁的一种工艺流程如下: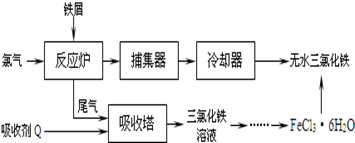
①吸收塔中发生反应的离子方程式为_________________________________________。
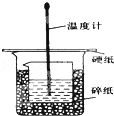
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:______________________________。
③用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容;取出10 mL,加入稍过量的KI溶液,充分反应后,滴入指示剂_________(填试剂名称),用c mol/L的Na2S2O3溶液进行滴定,终点时消耗V mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。则样品中氯化铁的质量分数为____________。
④某同学根据上述方案,使用上述(2)中获得的FeCl3•6H2O样品代替无水氯化铁样品进行测定,通过计算发现产品中的质量分数大于100%,其原因可能是____________________。
 3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;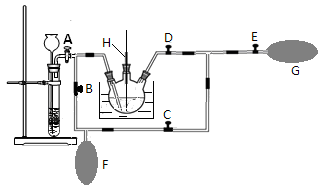



 粤公网安备 44130202000953号
粤公网安备 44130202000953号