卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)卤族元素位于周期表的_________区;溴的电子排布式为______________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是 。
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
| |
氟 |
氯 |
溴 |
碘 |
铍 |
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4(填“>”、“<”或“=”)
(5)已知ClO2-立体构型为V型。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的化学式__________(写出1个)
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。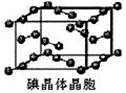
A、用均摊法可知平均每个晶胞中有4个碘原子
B、碘晶体为无限延伸的空间结构,是原子晶体
C、碘晶体中存在非极性键和范德华力

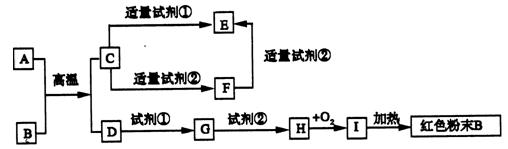
 →F的离子方程式:_____________________________________________
→F的离子方程式:_____________________________________________ 求出原稀溶液中I-浓度,滴定时的反应为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI。试回答:
求出原稀溶液中I-浓度,滴定时的反应为:2Na2S2O3 + I2 = Na2S4O6 + 2NaI。试回答: ____________(填“是”或“不是”);若为AgX沉淀,则它的化学式为__________(若不为AgX沉淀,则此空不填)。
____________(填“是”或“不是”);若为AgX沉淀,则它的化学式为__________(若不为AgX沉淀,则此空不填)。
 _______。
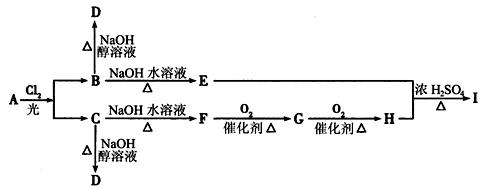
_______。
 完全反应,生成Ag的质量为____________g。
完全反应,生成Ag的质量为____________g。 粤公网安备 44130202000953号
粤公网安备 44130202000953号