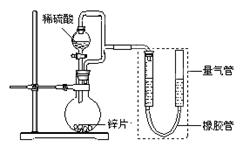
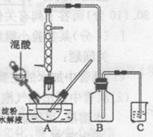
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A 100mL量筒 B 托盘天平 C 玻璃棒 D 50mL容量瓶
E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是 。
(2)本实验需量取浓硫酸的体积为 mL,量取时应选择的仪器是(填上述字母) 。
(3)在容量瓶使用方法中,下列操作不正确的是(填字母) 。
| A.使用容量瓶前检查它是否漏水 |
| B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| C.将确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀 |
(4)下列情况使所配制的稀硫酸浓度偏大是 (填序号)
①所用的浓硫酸长时间放置在密封不好的容器中
②容量瓶用蒸馏洗涤后残留有少量的水
③定容时俯视溶液的凹液面

 粤公网安备 44130202000953号
粤公网安备 44130202000953号