铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe  FeSO4+Cu
FeSO4+Cu
上述两种方法中,铜元素均被_____ _____ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
①步骤1中反应的离子方程式是______ _________。
②步骤2所加的氧化剂最适宜的是____________ ________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为____ ______
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是____ ______(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是__________ _____________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填
“Cu”或“C”)。并写出电极反应式。
。


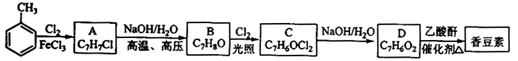
 其中:
其中: ____________ 、_______________________、________________________。
____________ 、_______________________、________________________。
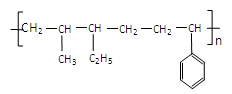 结构的橡胶。
结构的橡胶。 _____
_____ 乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
 式是______________。
式是______________。 _____;
_____; ;
;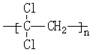 )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____________________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由____________________(写结构简式)发生加聚反应生成的。 H(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________________________(填序号)。
H(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是____________________________(填序号)。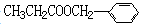 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下。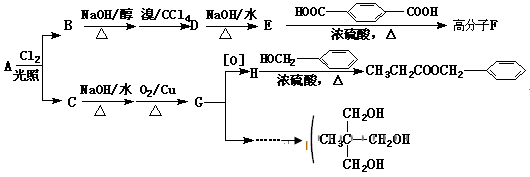
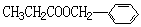 互为同分异构体的是____________________ (填序号)。
互为同分异构体的是____________________ (填序号)。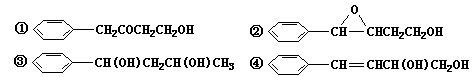
 ___________________;
___________________; 粤公网安备 44130202000953号
粤公网安备 44130202000953号