某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答有关问题。
| 实验步骤 |
有关问题 |
| ①计算所需KCl的质量 |
需要KCl的质量为________g(保留小数点后一位) |
| ②称量KCl固体 |
称量需要用到的主要仪器是________________ |
| ③将KCl加入100 mL烧杯中,并加入适量水 |
为了加快溶解速率,可以采取哪些措施? ________________ |
| ④将烧杯中溶液转移至500 mL容量瓶中 |
为了防止溶液溅出,应采取什么措施? __________________ |
| ⑤向容量瓶中加蒸馏水至刻度线 |
在进行此操作时当加水至离刻度线1 cm~2 cm处应如何操作?____________________ |
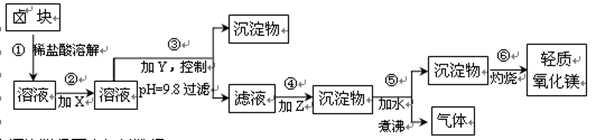
(1)上述实验中使用容量瓶前应检验_________________________________________________。
(2)在进行④步操作时未将洗涤烧杯、玻璃棒的洗涤液转移至容量瓶,则配制溶液浓度
________(填“偏高”、“偏低”或“不影响”)。
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需________。
 2SO3(g)
2SO3(g) 2SO3(g)△H=。
2SO3(g)△H=。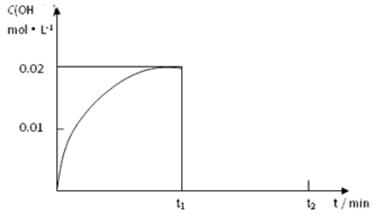
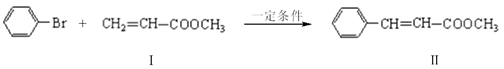
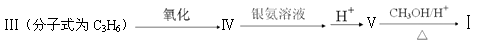
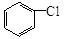 与
与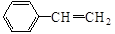 也可以发生类似反应①的反应,其有机产物的结构简式为。
也可以发生类似反应①的反应,其有机产物的结构简式为。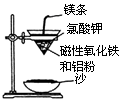
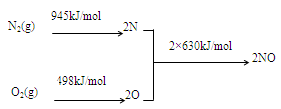
 2NO(g)△H= 。
2NO(g)△H= 。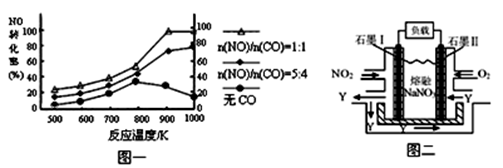
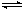 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。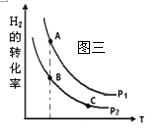
 粤公网安备 44130202000953号
粤公网安备 44130202000953号