(1)研究硫及其化合物性质有重要意义。
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g) 2SO3(g)。向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系
2SO3(g)。向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系
如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。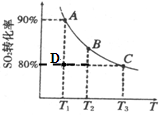
温度为T1时,反应的平衡常数K= 。(单位必须写)若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍 b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变); 在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a.KNO3溶液 b.AlCl3溶液 c.Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号