工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===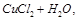 FeO+2HCl===
FeO+2HCl===
已知: .6时
.6时 以
以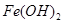 形式完全沉淀;
形式完全沉淀; .4时
.4时 以
以 形式完全沉淀;pH在3至4时
形式完全沉淀;pH在3至4时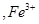 以
以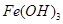 形式完全沉淀。除去溶液中的
形式完全沉淀。除去溶液中的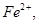 可以采用的方法是( )
可以采用的方法是( )
A.直接加碱,调整溶液 .6 .6 |
B.加纯铜粉,将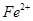 还原出来 还原出来 |
C.先将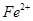 氧化成 氧化成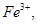 再调整pH至3至4 再调整pH至3至4 |
D.通入硫化氢,使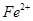 直接沉淀 直接沉淀 |
工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl===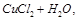 FeO+2HCl===
FeO+2HCl===
已知: .6时
.6时 以
以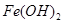 形式完全沉淀;
形式完全沉淀; .4时
.4时 以
以 形式完全沉淀;pH在3至4时
形式完全沉淀;pH在3至4时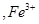 以
以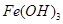 形式完全沉淀。除去溶液中的
形式完全沉淀。除去溶液中的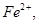 可以采用的方法是( )
可以采用的方法是( )
A.直接加碱,调整溶液 .6 .6 |
B.加纯铜粉,将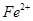 还原出来 还原出来 |
C.先将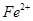 氧化成 氧化成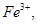 再调整pH至3至4 再调整pH至3至4 |
D.通入硫化氢,使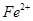 直接沉淀 直接沉淀 |