有A、B、C、D、E五种短周期元素,其原子序数依次增大。A是形成化合物种类最多的元素之一,B原子核外最外层电子数是次外层电子数的2倍,C元素的基态原子2p能级上电子数是2s能级的2倍,D是该周期中原子半径最大的主族元素,E的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575。请回答下列问题:
(1)C、D两元素形成的化合物的晶体类型是 。BC2的电子式 。
(2)若F是D的同主族下一周期元素,则F的电子排布式是: 。
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式 。
(4)写出A2BC3的结构式______________________。
 O2(g)===CO2(g)ΔH2=-283.0 kJ·mol-1
O2(g)===CO2(g)ΔH2=-283.0 kJ·mol-1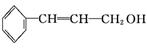
 粤公网安备 44130202000953号
粤公网安备 44130202000953号