(每空2分,14分)硫酸有着重要的用途,硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计了以下实验方案,将硫酸废渣中金属元素转化为氢氧化物沉淀分离开来。
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
1.9 |
3.7 |
9.6 |
| 沉淀完全时的pH |
3.2 |
5.2 |
11.0 |
(1)固体A溶于NaOH溶液的化学方程式为_____________________________________。
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_______________________________________________。
(3)上述流程中的试剂Y最好选用下列中的 (选填字母编号)。
A.水 B.氧化镁 C.氨水 D.氢氧化钠
(4)写出溶液D中的金属离子在加入试剂Y时发生反应的离子方程式 ;
。
(5)实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,所用仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→ ,装置C中应盛放的试剂为 。
相关知识点

 Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
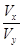 =___________(填数值);
=___________(填数值); 粤公网安备 44130202000953号
粤公网安备 44130202000953号