某学生欲配制6.0 mol/L的H2SO4 1000mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol/L的硫酸:②150 mL 25%的硫酸(p=" 1.18" g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A将①②两溶液全部在烧杯中混合均匀:
B用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿烧杯内壁倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀:
C将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中:
D ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1 cm~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
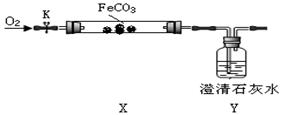
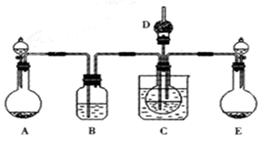
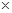 105Pa)的体积。
105Pa)的体积。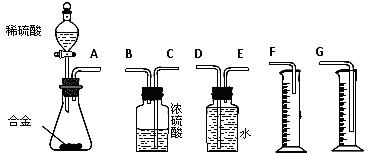
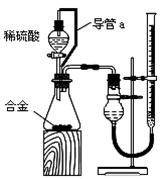




 粤公网安备 44130202000953号
粤公网安备 44130202000953号