工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,已知此反应是放热反应。
NH3+CO2+H2O+NaCl(饱和)= NaHCO3(晶体)↓+NH4Cl
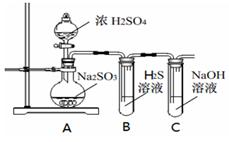
(1)利用上述反应原理,设计如下图所示装置,制取碳酸氢钠晶体.B中盛有饱和碳酸氢钠溶液,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.制取碳酸氢钠晶体可供选用的药品有:a.石灰石 b.生石灰 c.6mol/L盐酸 d.稀硫酸
e.浓氨水 f.饱和氯化钠溶液。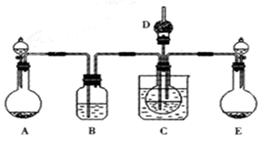
①A中制备气体时,所需药品是(选填字母代 号) ;
①B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④E装置向C中通气的导管不能插入液面下的原因是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图所示实验:
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号