有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为
AG=lg(c(H+)/c(OH-))。请回答下列问题:
(1)在25℃时,若溶液呈中性,则AG= 。
(2)在25℃时,若溶液的pH=12,则AG= 。
(3)在25℃时,溶液的pH与AG的换算公式为AG= (要化简)。
(4)在25℃时,将AG=-12的NaOH溶液aL与AG=12的H2SO4溶液bL混合(混合后的体积误差可以 忽略),若所得混合液的AG=10,则a∶b= 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。


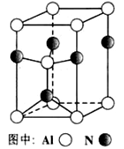 (1)在焙烧明矾的反应中,还原剂是 ;
(1)在焙烧明矾的反应中,还原剂是 ; 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;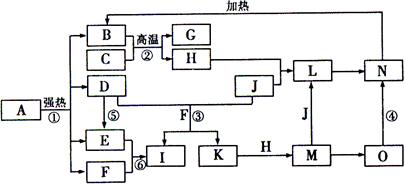
 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H