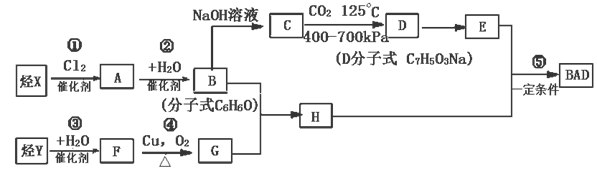
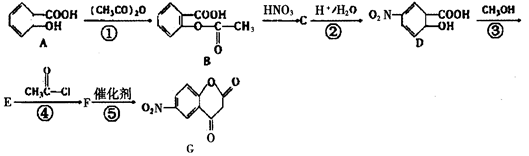
A B C
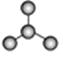
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称 。②该有机物的同分异构体的核磁共振氢谱中应有 个峰
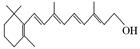
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为 。②1 mol维生素A最多可与 mol H2发生加成反应。
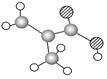
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为
②该物质中所含官能团的名称为 和

 2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号