甲醇是一种可再生的优质燃料,用途广泛,研究其作用具有广阔前景。
(1)已知在常温常压下,测得反应的反应热如下:
① 2CH3OH(l)+ 3O2(g)  2CO2(g) +4H2O(g) ∆H1= -1275.6 kJ/mol
2CO2(g) +4H2O(g) ∆H1= -1275.6 kJ/mol
② 2CO(g) +O2(g)  2CO2(g) ∆H2=-566.0 kJ/mol
2CO2(g) ∆H2=-566.0 kJ/mol
CH3OH不完全燃烧生成CO和气态水的热化学方程式是 。
(2)工业上生产甲醇的反应如下:CO2(g) + 3H2(g)  CH3OH(g)+ H2O(g) ∆H = -49 kJ/mol
CH3OH(g)+ H2O(g) ∆H = -49 kJ/mol
在某温度下,容积均为1 L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容。容器B中经10 s后达到平衡。达到平衡时的有关数据如下表:
| 容器 |
A |
B |
| 反应物投入量 |
1 mol CO2(g)和3 mol H2(g) |
1 mol CH3OH(g)和1 mol H2O(g) |
| 反应能量变化 |
放出αkJ热量 |
吸收19.6 kJ热量 |
①从反应开始至达到平衡时,容器B中CH3OH的平均反应速率为 。
②该温度下,B容器中反应的化学平衡常数的数值为 。
③α= 。
④下列措施能使容器A中甲醇的产率增大的是 。
a.升高温度 b.将水蒸气从体系分离
c.用更有效的催化剂 d.将容器的容积缩小一半
(3)我国科学院化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池。甲醇燃料电池的工作原理如下图所示。
① 该电池工作时,b口通入的物质为 。
② 该电池正极的电极反应式为 。
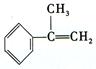 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: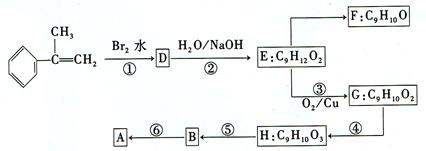
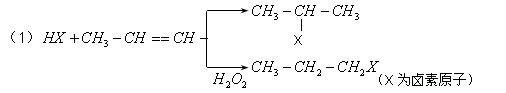
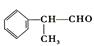 的物质,该物质是一种香料。
的物质,该物质是一种香料。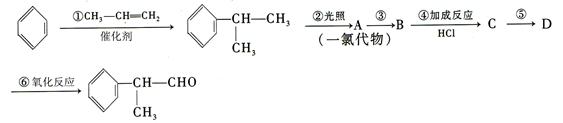
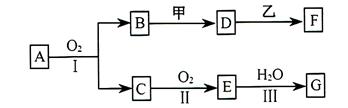
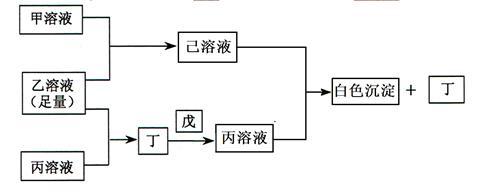
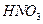 酸化的
酸化的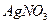 溶液有白色沉淀生成。则
溶液有白色沉淀生成。则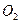 反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:___________________________________。
反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式:___________________________________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号