某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答: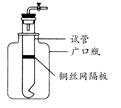
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体? 。该反应的离子方程式是: 。
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答:
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体? 。该反应的离子方程式是: 。