已知25°C时:
| 电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积 |
1.8×10-11 |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 完全沉淀时的pH |
9.7 |
5.0 |
5.5 |
4.0 |
在物质的提纯中,常利用难溶电解质的沉淀溶解平衡原理除去某些离子。例如:
①为了除去氯化铵晶体中的氯化铁杂质,先将混合物溶于水,再加入一定量的试剂a进行反应,过滤结晶即可;
②为了除去氯化镁晶体中的氯化铁杂质,先将混合物溶于水,再加入足量的氢氧化镁充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的硫酸亚铁杂质,先将混合物溶于水,再加入一定量的双氧水,将亚铁离子氧化,然后加入试剂b调节溶液的pH=4,过滤结晶即可。
(1)上述三种除杂方案都将Fe2+、Fe3+转化为________(填化学式)而除去。
(2)试剂a为________。
(3)写出②中除杂所发生的总反应的离子方程式:________。
(4)下列与方案③有关的叙述正确的是________(填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引入杂质,不产生污染
B.将亚铁离子氧化的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4的试剂b是氢氧化铜或氧化铜
D.在pH大于4的溶液中Fe3+已完全不存在
 ,在核磁共振氢谱中观察到峰值给出的强度之比为_______________。
,在核磁共振氢谱中观察到峰值给出的强度之比为_______________。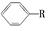 可以被KMnO4酸性溶液氧化生成
可以被KMnO4酸性溶液氧化生成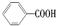 ,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化生成
,但若烷基R中直接与苯环连接的碳原子上没有C—H键,则不容易被氧化生成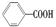 ,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成
,现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成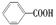 的异构体共有7种,其中的2种是
的异构体共有7种,其中的2种是 、
、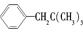
 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
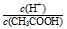 的比值将_______(填“增大”、“减小”或“无法确定”)。
的比值将_______(填“增大”、“减小”或“无法确定”)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号