侯氏制碱法的步骤如下图: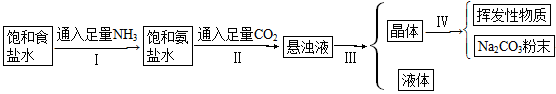
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应为
_______________________________________________
(2)由这一反应可知NaCl比NaHCO3溶解度______________________。
(3)Ⅲ的操作叫____________。
(4)Ⅳ的操作叫____________。
侯氏制碱法的步骤如下图:
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应为
_______________________________________________
(2)由这一反应可知NaCl比NaHCO3溶解度______________________。
(3)Ⅲ的操作叫____________。
(4)Ⅳ的操作叫____________。