利用海水可以提取溴和镁,提取过程如下。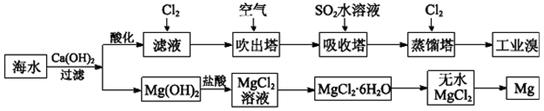
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是__________。用平衡移动原理解释通空气的主要目的是_______。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是________________、过滤、洗涤、干燥。
(3)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为________L(忽略Cl2的溶解)。
利用海水可以提取溴和镁,提取过程如下。
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是__________。用平衡移动原理解释通空气的主要目的是_______。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是________________、过滤、洗涤、干燥。
(3)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为________L(忽略Cl2的溶解)。