某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: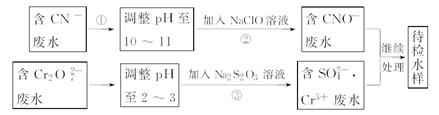
回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。
某工业废水中含有CN-和Cr2O72-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
(1)上述处理废水流程中主要采用的方法是_____________。
(2)流程②中,反应后无气体放出,该反应的离子方程式为_______。
(3)含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(4)反应③中,每消耗0.4 mol Cr2O72-转移2.4 mol e-,该反应离子方程式为________。