有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成5核10电子的离子X+ 。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程: 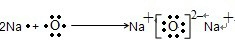
(2) A、B两元素组成的化合物A2B2存在的化学键是 (填“离子键”、“极性键”或“非极性键”)
有5种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成5核10电子的离子X+ 。试回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程: 
(2) A、B两元素组成的化合物A2B2存在的化学键是 (填“离子键”、“极性键”或“非极性键”)