已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;它有如图所示的转化关系。E是有香味的有机物,F是高分子化合物(已知醛类氧化可生成羧酸)。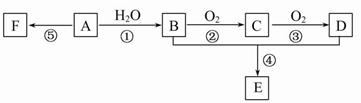
(1)B、D分子中的官能团名称分别是_________、_________。
(2)写出下列反应的化学方程式及反应类型:
①________;反应类型________。②________;反应类型________。
④________;反应类型________。⑤________;反应类型________。
相关知识点
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工发展水平;它有如图所示的转化关系。E是有香味的有机物,F是高分子化合物(已知醛类氧化可生成羧酸)。
(1)B、D分子中的官能团名称分别是_________、_________。
(2)写出下列反应的化学方程式及反应类型:
①________;反应类型________。②________;反应类型________。
④________;反应类型________。⑤________;反应类型________。