(1)人们常用催化剂来选择反应进行的方向,左图所示为一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
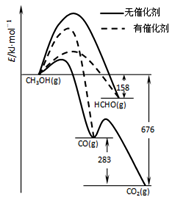
①写出1moLHCHO与O2发生反应时生成CO和H2O(g)的热化学方程式_______________;
②CH3OH与O2在有催化剂作用下反应,产物中HCHO比率大大提高的原因是_______________;
(2)①一定温度下,将N2H4与NO2以体积比为1:1置于10L定容容器中发生反应2N2H4(g)+2NO2(g) 3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
A.混合气体密度保持不变 B.2v正(NO2)=3v逆(N2)
C.N2H4与NO2体积比保持不变 D.体系压强保持不变
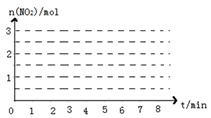
②在某温度下,10L密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
物质的量/mol
时间
|
n(N2H4)
|
n(NO2)
|
n(N2)
|
起始
|
2.0
|
3.0
|
0
|
第2min
|
1.5
|
a
|
0.75
|
第4min
|
1.2
|
b
|
1.2
|
第6min
|
1.0
|
c
|
1.5
|
第7min
|
1.0
|
c
|
1.5
|
ⅰ前2min内NO2的平均反应速率为_____________(保留2位有效数字,下同)该温度下反应的平衡常数K=___________________。
ⅱ关于上述反应,下列叙述不正确的是_____________。
A.达到平衡时,移走部分N2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡向右移动,c(N2H4)将变大
C.在相同条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,应选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入He,则此时v(逆) >v(正)
ⅲ.请画出该反应中n(NO2)随时间变化曲线,并画出在第7min分别升温、加压、加催化剂的情况下n(NO2)随时间变化示意图如图(在图上注明变化的条件)。

 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)





 3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
3N2(g)+4H2O(l)△H<0,下列能说明反应达到平衡状态的是_______;
 粤公网安备 44130202000953号
粤公网安备 44130202000953号