实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCl(浓)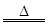 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)反应物中,氧化剂是________;化合价升高的元素是________。
(2)取一定体积的浓盐酸与MnO2发生反应,产生的氯气在标准状况下的体积为1.12 L(忽略Cl2的溶解)。则参加反应的HCl的物质的量是________;反应中被氧化的HCl的质量是________。(写出简要解题过程)
实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCl(浓)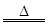 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)反应物中,氧化剂是________;化合价升高的元素是________。
(2)取一定体积的浓盐酸与MnO2发生反应,产生的氯气在标准状况下的体积为1.12 L(忽略Cl2的溶解)。则参加反应的HCl的物质的量是________;反应中被氧化的HCl的质量是________。(写出简要解题过程)