甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO (g) + 2H2(g)  CH3OH (g) △H 1 (反应1)
CH3OH (g) △H 1 (反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: △H2=-283 kJ·mol-1 (反应2)
△H2=-283 kJ·mol-1 (反应2)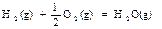 △H3=-242 kJ·mol-1 (反应3)
△H3=-242 kJ·mol-1 (反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C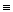 O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1= 。
(2)CH3OH (g)燃烧生成CO2( g)和H2O(g)的热化学方程式为:
g)和H2O(g)的热化学方程式为:
CH3OH(g)+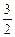 O2(g) ="=" CO2(g)+2H2O(g) △H4 该反应的焓变△H4= 。
O2(g) ="=" CO2(g)+2H2O(g) △H4 该反应的焓变△H4= 。
(3)反应1的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有 (写出2点)。既能提高产率,又能提高反应速率的措施是 。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+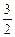 O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下: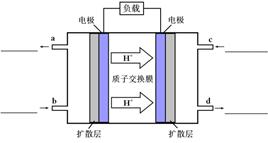
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 。
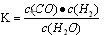
 与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。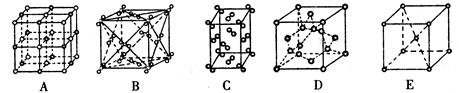

 粤公网安备 44130202000953号
粤公网安备 44130202000953号