某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。请回答: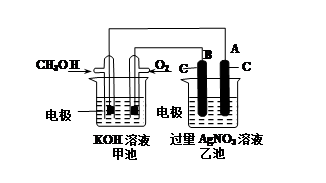
①通入O2的电极名称是 ,B电极的名称是 。
②通入CH3OH的电极的电极反应式是 ,A电极的电极反应式为 。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为
某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。请回答:
①通入O2的电极名称是 ,B电极的名称是 。
②通入CH3OH的电极的电极反应式是 ,A电极的电极反应式为 。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为