在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。


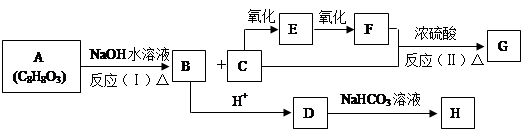
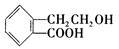 ,它可通过不同的化学反应分别制得B、C和D (下图)三种物质。
,它可通过不同的化学反应分别制得B、C和D (下图)三种物质。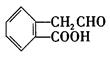
 粤公网安备 44130202000953号
粤公网安备 44130202000953号