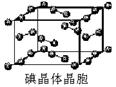
某含氧衍生物可以作为无铅汽油的抗爆剂,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式。(要有解题过程)
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
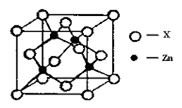
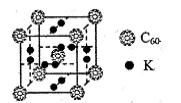
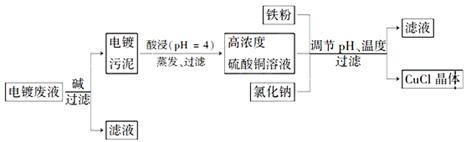

 2H2O(g) △H="-483.6" kJ/mol
2H2O(g) △H="-483.6" kJ/mol
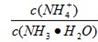 的值 (填“增大”、“减小”或“不变”);若将1mol•L-1NH4Cl溶液和1mol•L-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).
的值 (填“增大”、“减小”或“不变”);若将1mol•L-1NH4Cl溶液和1mol•L-1NaOH溶液混合后溶液恰好呈中性,则混合前NH4Cl溶液的体积 NaOH溶液的体积(填“大于”、“小于”或“等于”).