工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g)某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
| 容器编号 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡的时间/min |
达到平衡时体系能量的变化/kJ |
||
| CO |
H2O |
CO2 |
H2 |
||||
| ① |
650 |
1 |
2 |
0.4 |
0.4 |
5 |
16.4 |
| ② |
650 |
2 |
4 |
|
|
t1 |
Q1 |
| ③ |
900 |
2 |
4 |
1.6 |
1.6 |
t2 |
Q2 |
(1)计算容器②中反应的平衡常数K=_____________(计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为____________。
(3)容器①中反应达平衡这段时间,化学反应速率 =__________。
=__________。
(4)该反应的正反应为_______(填“吸热”或“放热”)反应,理由是____________。
(5)下列叙述正确的是____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2>Q1>32.8kJ
c.达到平衡的时间:t2>t1>2.5min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g) CO2(g)+H2(g) △H= -41kJ/mol
CO2(g)+H2(g) △H= -41kJ/mol
 nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答: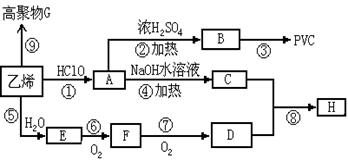

 CO (g) +H2 (g) △H=+131kJ•mol-1
CO (g) +H2 (g) △H=+131kJ•mol-1 CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向移动,减小压强则平衡向移动,降低温度则平衡向移动(填左,右,不)
CH3OH(g) △H>0给合成甲醇反应体系中通入少量CO则平衡向移动,减小压强则平衡向移动,降低温度则平衡向移动(填左,右,不) 粤公网安备 44130202000953号
粤公网安备 44130202000953号