A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。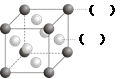
(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
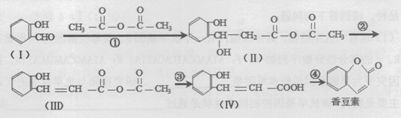
 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .

 + H2O
+ H2O 互为同系物;
互为同系物;
 谱图上只有一个峰,写出符合上述条件的W的结构简式。
谱图上只有一个峰,写出符合上述条件的W的结构简式。 反应过程中,理论上制备G的原子利用率为。
反应过程中,理论上制备G的原子利用率为。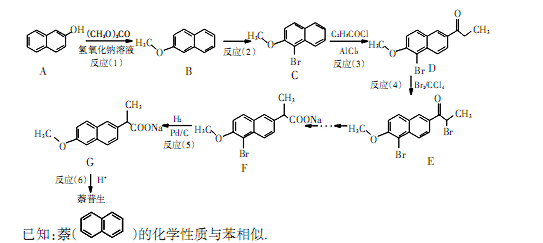
 反应试剂 目标产物)
反应试剂 目标产物)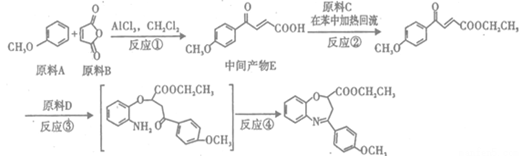
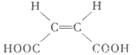 )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号