在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO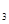 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO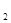 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO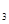 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO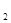 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。