Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式 。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。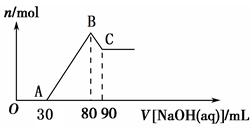
(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式 。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。
(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。