向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始时,溶液中Mn2+的浓度c将随时间的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如下图中①,做完实验后,得到的结果为下图中②,请说明下列问题: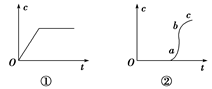
(1)写出H2O2与KMnO4反应的化学方程式。
(2)Oa段的意义。
(3)ab段的意义及ab段很陡的原因。
(4)bc段的意义。
向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始时,溶液中Mn2+的浓度c将随时间的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如下图中①,做完实验后,得到的结果为下图中②,请说明下列问题:
(1)写出H2O2与KMnO4反应的化学方程式。
(2)Oa段的意义。
(3)ab段的意义及ab段很陡的原因。
(4)bc段的意义。