现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表中:
c.高分子结构示意图.
(2)高分子材料的主要性质特点:
| A.具有热塑性 | B.可溶于有机溶剂 |
| C.不溶于有机溶剂 | D.具有确定的熔点 |
(3)主要应用:
a.用于制备塑料薄膜
b.用于制备光学仪器
c.用于制备车辆轮胎
| 硫化橡胶 |
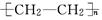 |
 |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表中:
c.高分子结构示意图.
(2)高分子材料的主要性质特点:
| A.具有热塑性 | B.可溶于有机溶剂 |
| C.不溶于有机溶剂 | D.具有确定的熔点 |
(3)主要应用:
a.用于制备塑料薄膜
b.用于制备光学仪器
c.用于制备车辆轮胎
| 硫化橡胶 |
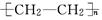 |
 |
| ① |
|
|
| ② |
|
|
| ③ |
|
|