某有机物含有C、H、O、N四种元素,如图为该有机物的球棍模型.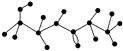
(1)该有机物的化学式________________,结构简式________________;
(2)该物质属于________;
A.有机物 B.氨基酸 C.二肽 D.糖 E.油脂
(3)该有机物可能发生的化学反应有(填编号)________;
①水解 ②加聚 ③取代 ④消去 ⑤酯化 ⑥与H2加成
(4)该有机物发生水解反应的化学方程式为______________________________.
某有机物含有C、H、O、N四种元素,如图为该有机物的球棍模型.
(1)该有机物的化学式________________,结构简式________________;
(2)该物质属于________;
A.有机物 B.氨基酸 C.二肽 D.糖 E.油脂
(3)该有机物可能发生的化学反应有(填编号)________;
①水解 ②加聚 ③取代 ④消去 ⑤酯化 ⑥与H2加成
(4)该有机物发生水解反应的化学方程式为______________________________.