某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量是___________________。
(3)该化合物的化学式(分子式)是__________________。
(4)该化合物分子中最多含_________个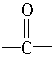 官能团。
官能团。
某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量是___________________。
(3)该化合物的化学式(分子式)是__________________。
(4)该化合物分子中最多含_________个 官能团。
官能团。