2SO2(g)+ O2(g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
温度/℃
|
400
|
500
|
600
|
SO2转化率/%
|
99.2
|
93.5
|
73.7
|
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3•H2O)=" 2[c()+" c()+ c(H2SO3)]
b. c()+ c(H+)=" c()+" c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。
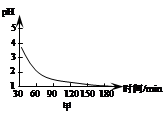

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。