某小组取一定质量的FeSO4固体,利用下图装置进行实验。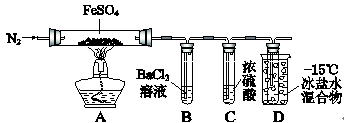
| |
实验过程 |
实验现象 |
| ① |
通入一段时间N2,加热 |
A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② |
用带有火星的木条靠近装置D的导管口 |
木条复燃 |
| ③ |
充分反应,停止加热,冷却后,取A中固体,加盐酸 |
固体溶解,溶液呈黄色 |
| ④ |
将③所得溶液滴入D试管中 |
溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是_______。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是_______。
(3)实验④反应的离子方程式是_______。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)_______。

 ,需在装置中添加M于 (选填序号)。
,需在装置中添加M于 (选填序号)。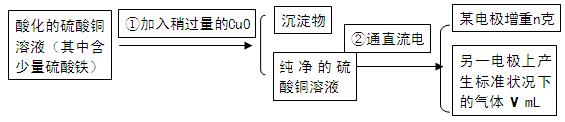
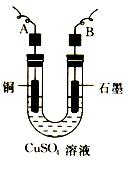
 成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题:
成功,解决了人类的重要的饥饿问题.我们在实验室中也常用NH4Cl和Ca(OH)2反应来制取一些氨气以便研究它的性质.请回答下列问题: .
.
 NH4Cl和Ca(OH)2制取氨气的反应方
NH4Cl和Ca(OH)2制取氨气的反应方 程式:_______________.
程式:_______________. 气的试剂瓶中可以看到的现象是___________________.
气的试剂瓶中可以看到的现象是___________________.
 写出下列反应的化学方程式:
写出下列反应的化学方程式: __________________________________________.
__________________________________________.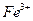 外还可能含有
外还可能含有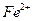 ;若要确认其中含有
;若要确认其中含有 溶液
溶液
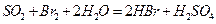 ;然后加入足量
;然后加入足量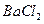 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中 的体积分数为 _____ 。
的体积分数为 _____ 。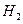 和Q气体。
和Q气体。 为此设计了下列探究实验状置(图中夹持仪器省略)。
为此设计了下列探究实验状置(图中夹持仪器省略)。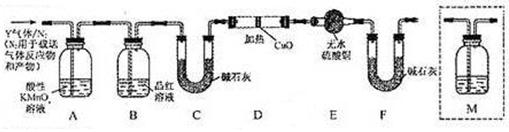
 粤公网安备 44130202000953号
粤公网安备 44130202000953号