水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
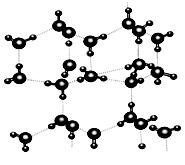
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为:。
(2)位于第四周期,与氧元素同主族的元素名称是:;其外围电子排布式是:。
(3)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是:。
(4)已知:2H2O  H3O++OH-,H3O+的立体构型是,H3O+中含有一种特殊的共价键叫做。
H3O++OH-,H3O+的立体构型是,H3O+中含有一种特殊的共价键叫做。
(5)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(6)水的分解温度远高于其沸点的原因是:
________________________________________________________________________